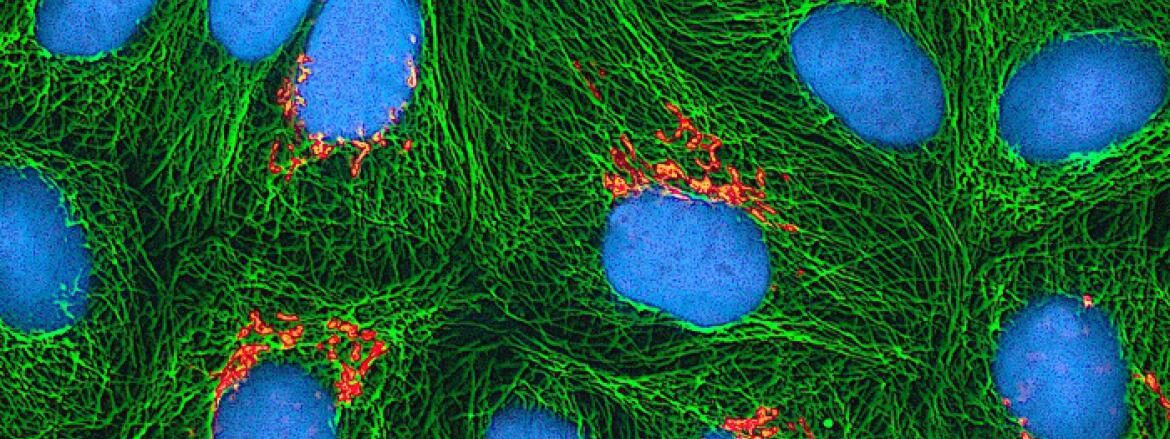
Avant toute chose, une petite leçon de biologie moléculaire s’impose. Commençons par la base même de notre organisme : l’ADN.
Présent dans le noyau de chacune de nos cellules, l’ADN (acide désoxyribonucléique) renferme toutes les informations relatives au fonctionnement de ces dernières. Il se présente sous la forme d’une très longue chaîne dont nos gènes sont les maillons. Ces gènes sont autant d’instructions nécessaires à nos cellules pour croître, se diviser, ou accomplir des taches particulières (on parle de “spécialisation”) via la production de protéines. Pour que ces instructions soient mises en oeuvre, ils faut qu’elles soient transférées du noyau vers la partie “active” de la cellule, le cytoplasme. Pour cela, la cellule produit une molécule appelée Acide Ribonucléique messager, ou ARNm. Cet ARNm est en quelque sorte une copie de l’ADN envoyée dans le cytoplasme, où il peut “transmettre” les consignes nécessaires à la production de protéines par la cellule.
Pour reprendre une métaphore employée sur le blog de la fondation Cancer Research UK, il faut voir l’ADN comme un grimoire renfermant une formule magique – un gène – pour chacune des taches que vous aurez à accomplir dans votre vie. Pratique, sauf que ce grimoire est enfermé dans un donjon – le noyau de la cellule – et ne peut en sortir. Pour disposer des formules, il faut donc les recopier dans un carnet – l’ARN messager.
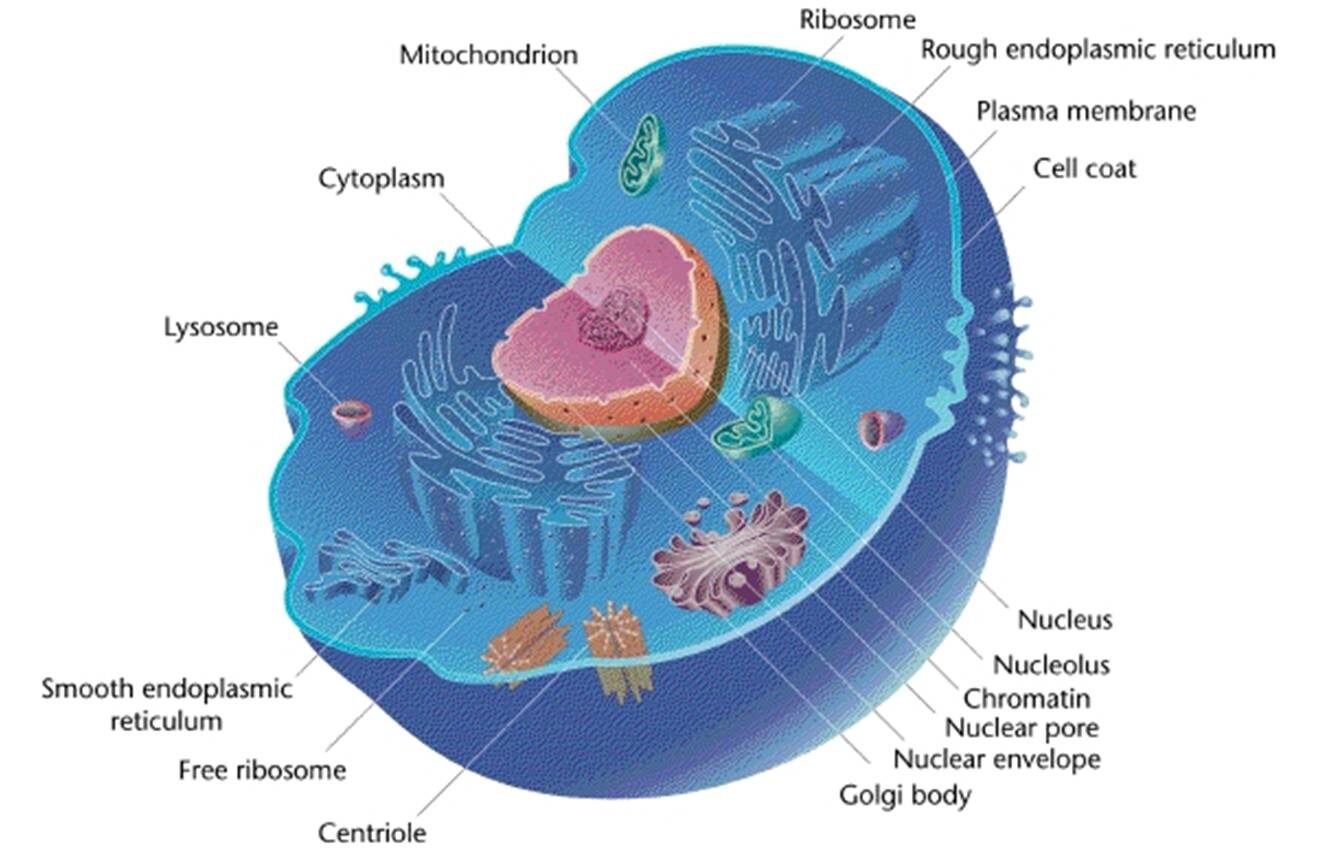
Au centre, en rose, le noyau. En bleu autour, abritant les autres fonctions cellulaires, le cytoplasme.
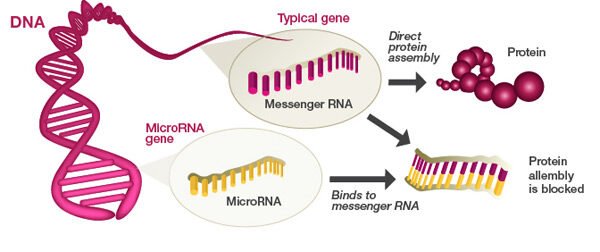
Longtemps, les chercheurs se sont demandés comment une cellule de peau et une cellule d’estomac pouvaient exercer des fonctions différentes puisque chacune d’entre elles contient la même séquence d’ADN recopiée sur la même séquence d’ARNm. C’est ici qu’intervient notre sujet du jour : le micro ARN – ou miARN.
Présentes dans le cytoplasme, les molécules de miARN se greffent à la séquence d’ARNm pour en effacer les gènes inutiles et ne laisser s’exprimer que ceux codant pour la fonction particulière de la cellule. En résumé, ce sont les miARN qui effacent les gènes utiles à la production de sucs gastriques dans l’ARNm des cellules de peau, et les gènes utiles à la production de mélanine dans les cellules d’estomac.
Le micro ARN à l’origine des cancers
À l’origine d’un cancer, on trouve une cellule ayant subi une mutation entraînant sa déficience. Certains gènes qui devraient s’y exprimer ne s’y expriment plus, et vice versa. Parmi les gènes bloqués, on trouve généralement p53, gène responsable de la destruction des cellules défectueuses. Au lieu de mourir, la cellule mutante se divise alors, et de nouvelles mutations apparaissent chez ses descendantes qui prolifèrent, empêchant l’organe attaqué de fonctionner correctement. Dans de nombreux cas, les cellules défectueuses s’agrègent en un amas de tissus que l’on appelle tumeur.
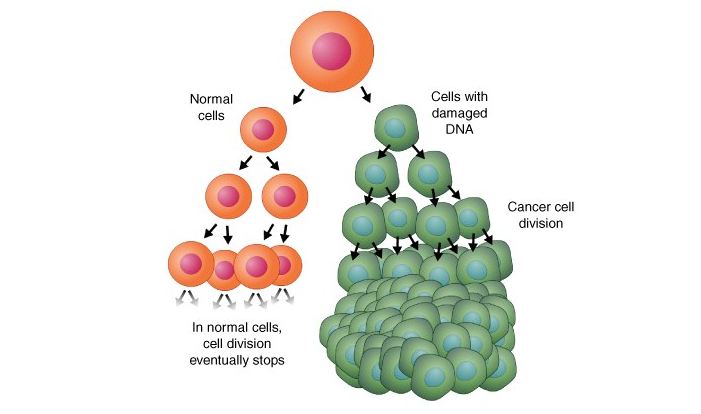
Ce que des recherches menées depuis une dizaine d’années semblent indiquer, c’est que l’expression défectueuse des gènes dans les cellules cancéreuses proviendrait de l’absence ou de la surabondance de certains micro ARN. De cette découverte pourraient découler des avancées majeures, tant dans le domaine du diagnostic de la maladie que dans celui de son traitement.
Vers des méthodes de dépistage non invasives
Dans leur article MicroRNA and Cancer publié en 2012 par la revue Molecular Oncology, M.D. Johnson et A.H. Lund rapportent deux éléments déterminants dans le rôle que le miARN peut jouer dans le dépistage du cancer. D’une part, pour un cancer donné, et à chaque étape de son évolution, les cellules cancéreuses présentent une “signature miARN spécifique”. D’autre part, les molécules de miARN ne se trouvent pas seulement à l’intérieur des cellules, mais également dans les fluides corporels comme le sérum ou l’urine, enfermé dans des petites poches appelées exosomes. C’est le pari de la startup Miroculus, et de son outil de dépistage Miriam. Il s’agit d’une plaque percée de 96 petits “puits”, dans chacun desquels est placée une solution qui réagit au contact d’un miARN particulier par un dégagement lumineux. Le sang prélevé au patient est réparti dans les puits. En observant ceux dont se dégage de la lumière, on peut savoir si ce dernier est atteint d’un cancer, duquel, et à quel stade. En France, des chercheurs du laboratoire d’analyse et d’architecture des systèmes du CNRS développent des robots nanoscopiques capables de se fixer aux miARN caractéristiques du cancer du pancréas et d’en rendre compte en émettant des ondes radio. La concentration des dits miARN dans le sang peut alors être quantifiée et l’avancement du cancer évalué. Ces méthodes révolutionnaires sont d’autant plus précieuses qu’elles viennent remplacer des procédures, invasives et risquées comme la biopsie, qui consiste à ouvrir le patient pour prélever un moreau de tumeur sur l’organe atteint afin de l’analyser. En guise de dépistage, une prise de sang régulière pourrait assurer de détecter rapidement la maladie et de la traiter avant qu’elle ne s’étende.
Vers des traitements ciblés plus efficaces
Une fois le cancer détecté, les miARN peuvent également constituer une approche thérapeutique intéressante, qui pourrait se substituer aux traitements lourds que sont la radiothérapie et la chimiothérapie. Dans une cellule cancéreuse, les gènes anti-tumeurs qui contrôlent le processus de division sont généralement éteints par des fragments de miARN mutants. En injectant dans la cellule de quoi inhiber ce miARN, on peut restaurer les fonctions régulatrices de la cellule, et ainsi empêcher la croissance du cancer, voire favoriser sa rémission. Le schéma ci-dessous illustre la façon dont lutter contre un niveau anormalement élevé de miARN 155 peut entraîner la disparition d’une tumeur chez une souris atteinte de lymphome. 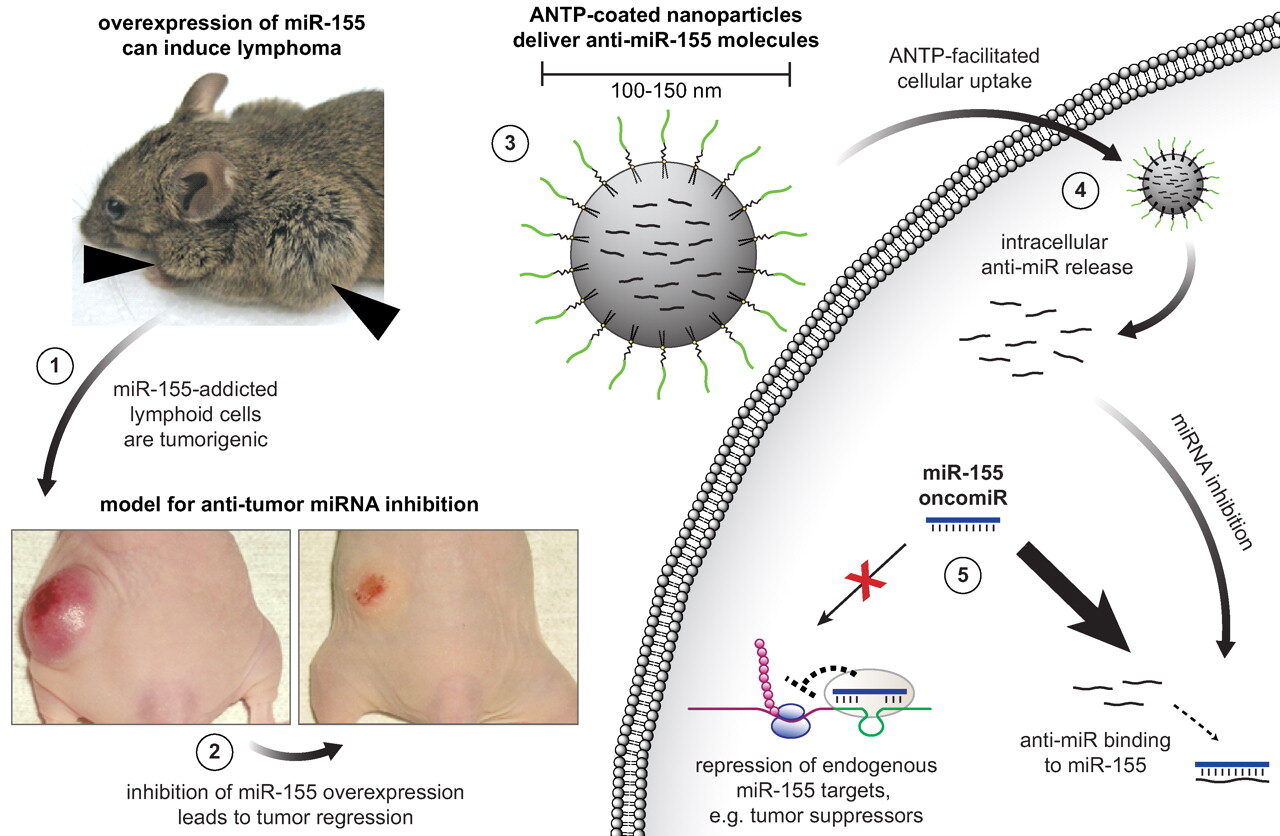 Cette technique peut également fonctionner dans l’autre sens, en réintroduisant du miARN manquant. Prenons l’exemple des miARN de type let-7, qui ont pour rôle d’éteindre les gênes mutants. Une présence réduite de let-7 dans les cellules est une caractéristique commune de nombreux cancers. Comme l’avancent Johnson et Lund, restaurer des niveaux normaux de let-7 dans une tumeur peut alors s’avérer une solution intéressante. La méthode a d’ailleurs fait ses preuves chez des souris atteintes de cancer du poumon, qui ont vu leurs tumeurs se réduire après injection de let-7b et let-7c dans les cellules atteintes. Causé par des mutations génétiques dont les mécanismes nous échappent encore, le cancer n’est pas prêt de disparaître, au sens propre du terme. En revanche, toutes expérimentales que soient les méthodes que nous venons d’aborder, elles portent l’espoir d’un futur proche dans lequel chaque cancer serait dépisté à temps et directement bloqué au niveau moléculaire. Ce qui est déjà, disons-le, pas mal du tout ! voir le reportage diffusé dans Futuremag
Cette technique peut également fonctionner dans l’autre sens, en réintroduisant du miARN manquant. Prenons l’exemple des miARN de type let-7, qui ont pour rôle d’éteindre les gênes mutants. Une présence réduite de let-7 dans les cellules est une caractéristique commune de nombreux cancers. Comme l’avancent Johnson et Lund, restaurer des niveaux normaux de let-7 dans une tumeur peut alors s’avérer une solution intéressante. La méthode a d’ailleurs fait ses preuves chez des souris atteintes de cancer du poumon, qui ont vu leurs tumeurs se réduire après injection de let-7b et let-7c dans les cellules atteintes. Causé par des mutations génétiques dont les mécanismes nous échappent encore, le cancer n’est pas prêt de disparaître, au sens propre du terme. En revanche, toutes expérimentales que soient les méthodes que nous venons d’aborder, elles portent l’espoir d’un futur proche dans lequel chaque cancer serait dépisté à temps et directement bloqué au niveau moléculaire. Ce qui est déjà, disons-le, pas mal du tout ! voir le reportage diffusé dans Futuremag